La Agencia Europea de Medicamentos y la Comisión Europea actualizan distintos aspectos sobre los biosimilares
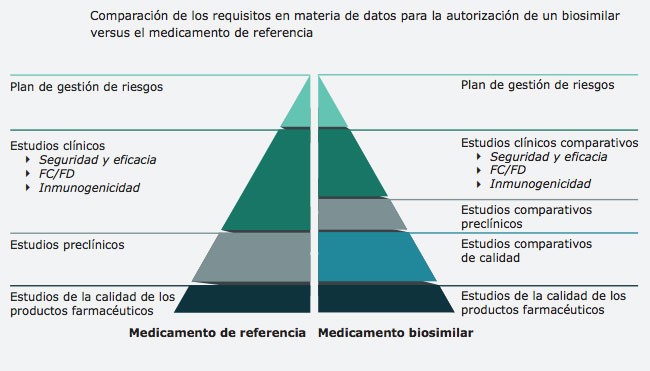
La Agencia Europea de Medicamentos (EMA) y la Comisión Europea han actualizado la "Guía informativa de biosimilares para profesionales sanitarios". Desde que en 2006 se autorizara el primer medicamento biosimilar, la UE ha sido pionera en la regulación de los biosimilares. En los últimos diez años, la UE ha aprobado el mayor número de estos medicamentos de todo el mundo.
La actualización de la guía sigue por este camino e incluye nuevas sustancias activas de biosimilares aprobados, como la insulina lispro, bevacizumab, trastuzumab y pegfilgrastim. Según el Prof. Guido Rasi, director ejecutivo de la EMA, "teniendo en cuenta que los profesionales sanitarios se encuentran en la primera línea de atención a los pacientes, es esencial que tengan acceso a información fiable sobre estos medicamentos". Rasi destaca que la nueva actualización proporciona a los profesionales sanitarios información de referencia tanto sobre la ciencia que fundamenta el uso de los biosimilares, como sobre la normativa que lo regula.
La nueva guía incluye nuevas sustancias activas biosimilares, como trastuzumab y bevacizumab entre otras
Sobre la seguridad de los medicamentos biosimilares, la EMA y la UE garantizan que son sometidos a pruebas de farmacovigilancia de igual modo que la de cualquier otro medicamento. En ese sentido, aseguran que "no existe ningún requisito particular de seguridad aplicable únicamente a los medicamentos biosimilares porque su proceso de desarrollo sea diferente".
Durante los últimos diez años, el sistema de supervisión de la UE relacionado con cuestiones de seguridad no ha identificado ninguna diferencia relevante en cuanto a la naturaleza, gravedad o frecuencia de los efectos adversos entre los biosimilares y sus medicamentos de referencia.
ENLACE COPIADO
ENLACE COPIADO